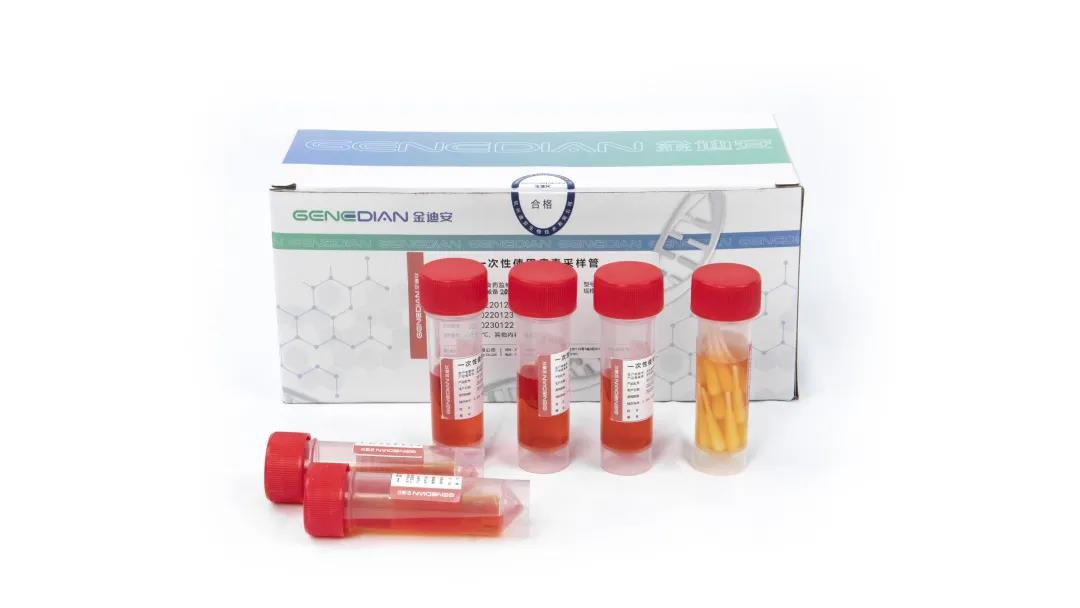
近日,迪安诊断旗下迪安生物自主研发生产的新冠核酸检测系列产品一次性使用病毒采样管(20合1)上市,此前推出的新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)也增加了多款适配机型。两大专业产品双重出击,为筑起国人安全防线贡献力量。 金迪安®一次性使用病毒采样管(20合1) 为进一步做好新冠病毒核酸检测,给疫情防控争取宝贵时间,在目前5合1、10合1混采检测基础上,国务院联防联控机制医疗救治组决定稳步实施20合1混采检测技术,并于日前组织制定了《新冠病毒核酸20合1混采检测技术规范》。 20合1混采检测技术是指将采集自20人的20支拭子集合于1个采集管中进行核酸检测的方法,能提升核酸检测能力及效率,落实早发现、早报告、早隔离、早治疗的“四早”要求。 产品备案凭证 《规范》发出后,迪安生物迅速反应仔细解读20合1混采技术规范,并于1月25日顺利取得20合1产品备案凭证,随即开展产品上市工作。 金迪安®一次性使用病毒采样管(20合1) 产品优势 1、12mL粉红色胍盐溶液,具备病毒灭活效能,无泄漏和被感染风险; 2、具备核酸稳定成分,样本采集后可室温保存7天; 3、采集管容量30mL,满足20支拭子采集保存要求; 4、可搭配本公司植绒拭子,拥有高效采集和释放率。 金迪安®新型冠状病毒2019-nCoV核酸检测 试剂盒(荧光PCR法) 1月17日,金迪安®新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)增加适配机型的变更通过国家药品监督管理局审核。 变更注册文件 金迪安®新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)通过系统的性能验证,在确保新冠核酸检测结果的稳定性和准确性的基础上增加Roche cobas Z480、ABI7500、SLAN-96P、MC-1000、MA-6000等多款荧光定量PCR仪,满足《医疗机构新型冠状病毒核酸检测工作手册(试行第二版)》对于PCR扩增仪器和核酸检测试剂配套的要求。 新型冠状病毒2019-nCoV核酸检测试剂盒有效性声明 迪安生物之前推出的自研产品——金迪安®新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)经多种突变株生物信息学比对、分析及性能研究,确认对上图声明中提及的多种已录入数据库的新冠突变株,不会出现漏检和脱靶的问题,是阻击奥密克戎的一大“利器”。 迪安生物一次性使用病毒采样管(20合1)的上市及新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)更多款适配机型的增加,让采样效率快速翻倍、筛查成本降低、工作量减少、检测试剂适用实验室极大增加,为当下形势严峻的疫情防控工作提供保障,为跑赢病毒赢得时间。 迪 安 生 物 杭州迪安生物技术有限公司致力于研发、生产和销售体外诊断试剂及相关仪器设备,拥有GMP标准建设的现代化体外诊断产品洁净生产车间,通过BSI认证的ISO13485质量管理体系认证。 迪安生物已经形成了“仪器设备+试剂耗材+智能一体化”的全场景解决方案,可提供新冠核酸检测相关的整套耗材、试剂、设备、移动方舱等产品,助力新冠核酸检测自动化、规模化、快速检测等全场景应用。面对依旧严峻复杂的全球疫情形势,公司将持续积极响应,为大规模新冠筛查贡献更大的力量。