近日,浙江大学医学院附属邵逸夫医院妇产科与迪安诊断合作完成的一项研究,成功登上了国际期刊《Frontiers in Oncology》(2024年IF=3.3)。这项研究依托迪安诊断临床基因组中心二代测序 (NGS) 平台,首次揭示了中国卵巢癌患者中一种极为罕见的基因组合——同时携带BRCA1与BRIP1基因致病性变异的“胚系双杂合性”(Germline Double Heterozygosity, GDH)的临床特征。并且通过与同一医院携带BRCA1/BRCA2胚系双杂合性致病变异的患者进行对比分析,为我们揭示了不同GDH组合对化疗耐受性和治疗效果的潜在影响,为卵巢癌的精准治疗带来了全新视角和宝贵依据。

论文发布截图
研究背景
卵巢癌是女性常见的恶性肿瘤之一,因其隐匿性强、早期难以发现,被称为“隐形杀手”。据统计,2020年全球报告了超过31万新病例和约20万死亡病例[1]。BRCA1和BRCA2基因变异是卵巢癌的重要危险因素。BRIP1基因作为BRCA1的“亲密搭档”,同样参与DNA修复,是重要的肿瘤抑制基因。根据美国国家综合癌症网络 (NCCN) 指南,BRCA1变异携带者终生患卵巢癌的风险高达39-58%,BRCA2为13-29%,而BRIP1则为5-15%[2]。
如果一个人同时携带两种不同基因的致病变异——“胚系双杂合性”(GDH),会发生什么?这正是本次研究关注的焦点。此前,BRCA1/BRCA2双杂合性卵巢癌病例多见于欧洲,亚洲极为罕见,而BRCA1/BRIP1双杂合性卵巢癌病例更是首次被报道。
该研究中纳入患者的临床特征
患者1,46岁女性,被诊断为晚期卵巢腺癌(FIGO IVB期),携带BRCA1:c.3288_3289del (p.Leu1098SerfsTer4)和BRIP1:c.3072del (p.Ser1025HisfsTer34) 两种致病变异。
该患者在接受5轮含铂化疗过程中,出现严重的胃肠道副作用而停止化疗。转诊至邵逸夫医院妇产科后,接受3个周期新辅助化疗后手术,术后额外接受了3个周期的含铂化疗。这期间由于1-4级显著的血液学毒性,需要进行多次药物剂量调整,且术后并发乳糜漏,治疗耐受性较差。该患者目前接受奥拉帕利(PARP抑制剂)维持治疗,门诊随访17个月(至2024年底),且没有新的病灶出现,疾病保持稳定。
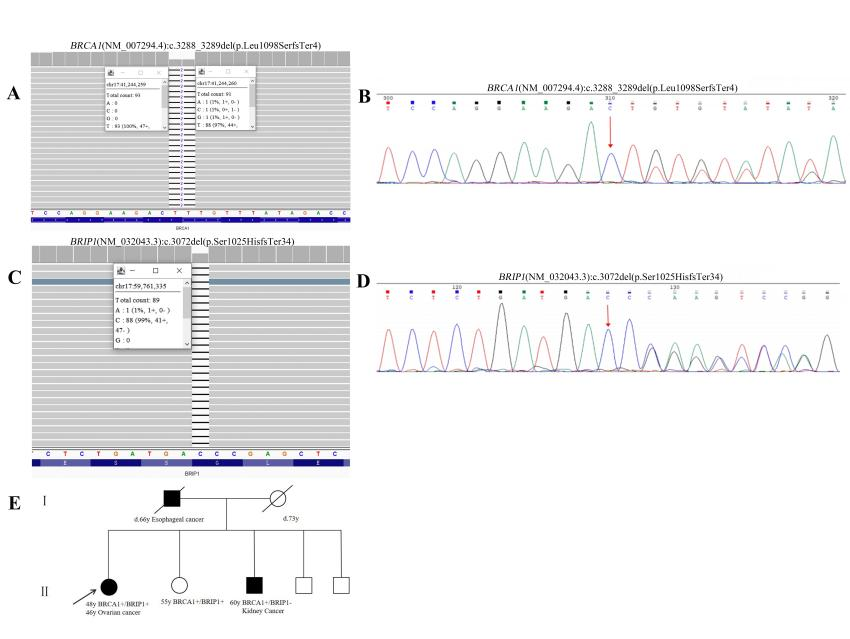
患者1的家系谱图和分子检测结果
患者2,44岁女性,被诊断为高级别浆液性卵巢癌(FIGO IIIC期),携带BRCA1:c.4065_4068del(p.Asn1355LysfsTer10)和BRCA2:c.5073dup(p.Trp1692MetfsTer3) 两种致病变异。
该患者耐受化疗良好,完成6个周期含铂方案后接受奥拉帕利维持治疗,随访53个月无疾病复发(至2024年底)。该患者没有出现疾病复发,预后理想。
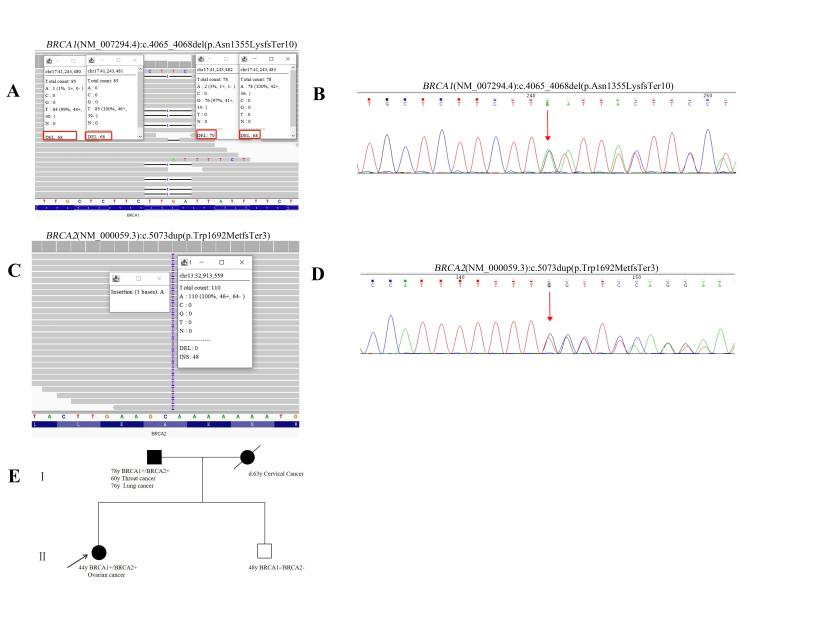
患者2的家系谱图和分子检测结果
精准医疗的启示:基因组合决定治疗策略
1. GDH的异质性
两例患者均接受了全外显子组测序(WES)确认基因变异,且均获益于PARP抑制剂维持治疗。两位患者虽同为“胚系双杂合性”,但不同的基因组合 (BRCA1/BRIP1 vs. BRCA1/BRCA2) 却带来了截然不同的化疗耐受性和术后恢复。这提示我们,GDH并非一个单一概念,内部存在显著异质性,值得更深入研究。
2. BRCA1/BRIP1组合的挑战
机制上,BRCA1和BRIP1的结构域在DNA修复通路中至关重要。双杂合性变异可能严重削弱细胞修复铂类化疗引起DNA损伤的能力,且BRIP1变异还可能增加血液学毒性风险。临床上,对这类患者应个体化调整化疗剂量,密切监测血液学指标,必要时提前采取支持治疗。
3. PARP抑制剂的普适性
令人鼓舞的是,两名患者都从PARP抑制剂奥拉帕利的维持治疗中获益,病情得到了有效控制。这再次印证了PARP抑制剂在BRCA相关卵巢癌治疗中的重要地位,也为GDH患者提供了有效的靶向治疗选择。
4.早筛与遗传咨询的重要性
在研究中,根据文献统计发现,GDH患者发病年龄可能更年轻,且多为晚期。这提示我们,对于有家族肿瘤史或符合遗传性肿瘤筛查指征的女性,应加强早期筛查和遗传咨询,以便及早发现风险,采取预防或干预措施。
研究小结
本研究首次对卵巢癌中BRCA1/BRIP1 GDH变异进行了表征,并将其临床影响与BRCA1/BRCA2 GDH变异进行了比较。研究结果强调了不同GDH变异组合对化疗耐受性及治疗效果的影响差异。结果提示,携带BRCA1/BRIP1 GDH变异的患者,可能需要针对铂类化疗进行个体化剂量调整,以在最大限度发挥疗效的同时降低毒性。此外,为减轻血液学毒性,或需更频繁地监测全血细胞计数,并及早或预防性使用造血生长因子及提供营养支持。鉴于本研究样本量有限(n=2),且缺乏功能性验证,这些结果需谨慎解读,仅作为生成假设的依据。还需要进一步的功能性和临床研究,以深入阐明其分子机制并优化GDH相关卵巢癌的治疗策略。
随着多基因检测技术的普及,越来越多罕见基因组合将被发现。未来,我们期待通过综合基因信息、临床表现和治疗反应,真正实现“一人一策”,为患者量身定制最佳治疗方案,提升生存质量与预后。
参考文献
[1] Huang J, Chan WC, Ngai CH, Lok V, Zhang L, Lucero-Prisno DE, et al. Worldwide Burden, Risk Factors, and Temporal Trends of Ovarian Cancer: A Global Study. Cancers (Basel). 2022 Apr 29;14(9):2230.
[2] NCCN Guidelines Version 1.2026: Genetic/Familial High-Risk Assessment: Breast, Ovarian, Pancreatic, and Prostate





